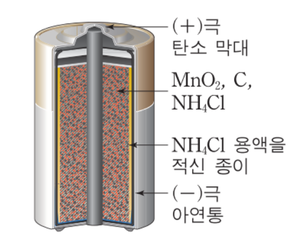
아연 탄소 전지(zinc-carbon cell)는 산화 전극인 아연과 이산화 망가니즈(MnO₂)로 덮여 있는 흑연을 환원 전극으로 사용한 전지를 뜻하며 르클랑셰 전지(Leclanché cell)로도 불린다. 대표적인 1차전지로 손전등, 휴대용 전자 제품 등에 널리 쓰인다.
아연 탄소 전지는 아연-망가니즈 건전지라고도 부른다. 음극은 아연으로 이루어져 있고, 양극은 이산화망가니즈와 탄소 막대로 이루어져 있다. 일반적으로 사용하는 건전지이다. 전해액으로 염화아연 수용액과 염화암모늄 수용액을 사용하고 전지 용기로 아연 관을 사용한다. 알라카인 전지보다 가격이 저렴하고 간헐방전 조건에서 수명이 길다. 전해액의 성분 차이로 인해 주로 소모 전류가 적으면서 오랜 시간 사용하는 탁상시계, 라디오, 리모컨, 벽시계, 카세트 등에 사용된다.
1800 년대 후반에 전해액은 액체 상태였다. 이로 인해 배터리를 운반하기가 어려웠다. 1866년에 조르주 르클랑셰(Georges Leclanché)는 아연 양극, 이산화망가니즈 음극 및 염화암모늄 용액을 전해질로 사용하여 배터리를 발명했다. 전해질은 여전히 액체이지만, 전체 화학은 오늘날의 건전지의 발명에 중요한 단계로 밝혀졌다.
염화 암모늄에서 전해질 페이스트를 만드는 방법을 알아 낸 사람은 카를 카스너(Carl Gassner)이다. 1886년 독일에서 르클랑셰 전지를 개량하여 새로운 "건전지"배터리를 발표했다.
일반적으로 "아연 탄소 전지"라고 불리는 이 새로운 건전지는 1950년대 후반까지 대량 생산되었다. 그때 탄소는 화학 반응에 관여하지 않지만 아연 탄소 전지에서 전기 전도체로 작용한다.[1]
전기 화학 반응[편집]
아연 탄소 전지에서 일어나는 전기 화학 반응은 아래와 같다.
산화 전극 : Zn(s) → Zn²⁺ (aq) + 2e⁻
환원 전극 : 2Mn0₂(s) + 2NH₄⁺(aq) + 2e⁻ → Mn₂0₃(s) + 2NH₃(aq) + H₂0(/)
전체 반응 : Zn(s) + 2MnO₂(s) + 2NH₄⁺ (aq) → Zn²⁺(aq) + Mn₂O₃(s) + 2NH₃(aq) +H₂0(/)
아연 탄소 전지는 초기에 약 1.5 V의 전압을 발생시킨다.
그러나 시간이 지남에 따라 전지의 전압이 떨어지는 단점을 가지고 있다.
그 원인으로는 먼저 산화 전극에서 아연의 부식 과정이 일어나는 수가 있고, 환원 전극에서는 물이 생겨남에 따라 전지 내에 있는 반응물과 전해질의 농도가 낮아지기 때문이다.
이러한 현상을 완화하기 위해서 아연 전극에 수은이 들어 있는 염(salt)을 넣어주면 아말감(amalgam)을 형성하여 부식을 방지할 수 있으나 지금은 수은의 유독성 문제로 사용하지 않는다.
다른 방법으로 전해질에 염화 아연(ZnCl₂)을 첨가하면 다음 반응에 의해 물이 발생하는 것을 억제할 수 있다.
4Zn²⁺ + ZnCl₂ + 8OH⁻ + H₂O → ZnCl₂·4ZnO·5H₂O
그래서 실제 아연 탄소 전지에서는 염화 암모늄과 염화 아연의 혼합물을 전해질로 사용한다.
참고자료[편집]
같이 보기[편집]
|
  이 아연 탄소 건전지 문서는 배터리에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요. 이 아연 탄소 건전지 문서는 배터리에 관한 글로서 검토가 필요합니다. 위키 문서는 누구든지 자유롭게 편집할 수 있습니다. [편집]을 눌러 문서 내용을 검토·수정해 주세요.
|
| 자동차 : 자동차 분류, 자동차 회사, 한국 자동차, 독일 자동차, 유럽 자동차, 미국 자동차, 중국 자동차, 일본 자동차, 전기자동차, 자동차 제조, 자동차 부품, 자동차 색상, 자동차 외장, 자동차 내장, 자동차 전장, 자동차 부품 회사, 배터리 □■⊕, 배터리 회사, 충전, 자동차 판매, 자동차 판매 회사, 자동차 관리, 자동차 역사, 자동차 인물
|
|
|
| 배터리 종류
|
1차전지 • 2차전지 • 3차전지 • AA 전지 • AAA 전지 • HFC • LCO • LFP • LMO • LTO • NCA • NCM • NCMA • 각형 배터리 • 건전지 • 고전압 배터리 • 고체전지 • 공기전지 • 과산화은전지 • 구반반 배터리 • 그래핀 배터리 • 금속 공기 배터리 • 나노셀룰로스 종이 배터리 • 나트륨이온 배터리 • 나트륨 황 배터리 • 납축전지 • 니켈 수소 배터리 • 니켈 카드뮴 배터리 • 다이아몬드 배터리 • 단추형 전지 • 대용량 배터리 • 대형배터리 • 동위원소 배터리 • 리튬공기전지 • 리튬 망간 배터리 • 리튬메탈 배터리 • 리튬 이산화탄소 배터리 • 리튬이온 배터리 • 리튬 인산철 배터리 • 리튬전지 • 리튬 코발트 배터리 • 리튬 티타네이트 배터리 • 리튬 폴리머 배터리 • 리튬 하이니켈 배터리 • 리튬 황 배터리 • 마그네슘 배터리 • 망가니즈전지 • 모래 배터리 • 무음극배터리 • 물리전지 • 미생물 연료전지 • 바나듐 배터리 • 바나듐 레독스 흐름 배터리 • 바나듐이온 배터리 • 바빌로니아 전지 • 박막배터리 • 박테리아 배터리 • 박테리아 종이 배터리 • 반고체 배터리 • 배터리 • 베타 배터리 • 보조배터리 • 볼타전지 • 불소이온 배터리 • 블레이드 배터리 • 비축전지 • 사원계 배터리 • 산화물 전고체 배터리 • 산화은전지 • 삼원계 배터리 • 설탕 배터리 • 세라믹 축전기 • 소금 배터리 • 소형배터리 • 수소연료전지 • 수은전지 • 슈퍼커패시터 • 습전지 • 아연공기전지 • 아연 탄소 전지(르클랑셰 전지) • 아폴로 • 알루미늄 공기전지 • 알루미늄 공기 흐름 전지 • 알칼리전지 • 얼티엄 배터리 • 에너지저장장치(ESS) • 에이터너스 • 연료전지 • 열전지 • 용융염 배터리 • 원자력전지 • 원통형 배터리 • 육둘둘 배터리 • 인섀시 배터리 • 전고체 배터리 • 전지 • 종이 배터리 • 중형배터리 • 차세대 배터리 • 초소형배터리 • 축전기(콘덴서) • 축전지 • 칼륨 배터리 • 칼슘 배터리 • 커패시터 • 코인셀 배터리 • 태양전지 • 파우치형 배터리 • 파워월 • 팔일일 배터리 • 폐배터리 • 폴리머 배터리 • 폴리머 전고체 배터리 • 프리폼 배터리 • 플렉서블 배터리 • 하이니켈 배터리 • 하이브리드 리튬메탈 배터리 • 해수전지 • 핵 배터리 • 화학전지 • 황화물 전고체 배터리 • 흐름전지(레독스 플로우 배터리)
|
|
|
| 배터리 기술
|
ALD • CCS • CSG • CTB • CTV • K-배터리 • MPI • MTB • NCMX • PCM • SRS • 건식분리막 • 계면 • 계면저항 • 계면활성제 • 고용량 • 고체전해질 • 고출력 • 공랭식 • 굴곡도 • 기공 • 기억효과(메모리 효과) • 냉각시스템 • 다공성 • 대용량 • 덴드라이트 • 드라이룸 • 모듈투바디(MTB) • 무기 고체 전해질 • 바인더 • 박막 • 박막화 • 방열판 • 방열핀 • 배터리관리시스템(BMS) • 배터리데이 • 배터리모듈 • 배터리 보호회로모듈 • 배터리셀 • 배터리 케이스 • 배터리 패키징 • 배터리팩 • 배터리하우징 • 배터리 히팅 시스템 • 복합전해질 • 분리막 • 블랙파우더 • 비전해질 • 사물배터리 • 산화물 • 산화물계 전해질 • 세라믹 코팅 • 세라믹 코팅 분리막 • 셀밸런싱 • 셀투바디(CTB) • 셀투비클(CTV) • 셀투섀시(CTC) • 셀투카(CTC) • 셀투팩(CTP) • 소용량 • 수랭식 • 스태킹 • 습식분리막 • 실리콘 음극재 • 실버코팅 • 안전성 강화 분리막(SRS) • 액체전해질 • 양극박 • 양극소재 • 양극재 • 양극판 • 양극활물질 • 여과 • 열폭주 • 열화현상 • 와인딩 • 용량 • 유기 고체 전해질 • 유랭식 • 음극소재 • 음극재 • 음극판 • 음극활물질 • 이온전달막 • 이온전도도 • 이온화 • 저용량 • 저출력 • 전고체 • 전구체 • 전지박 • 전해액 • 전해질 • 전해질막 • 점프 • 점프케이블 • 정격용량 • 정격전압 • 제로모듈 • 젤리롤 • 집전체 • 출력 • 침출 • 콤퍼레이터 • 티본 레이아웃 • 파우치 • 패스웨이 • 폐양극재 • 활물질 • 황화물 • 황화물계 전해질 • 히트싱크 • 히트파이프 • 히트펌프
|
|
|
| 배터리 제품
|
1865 배터리 • 2170 배터리 • 4680 배터리 • 기린 배터리
|
|
|
| 위키 : 자동차, 교통, 지역, 산업, 기업, 단체, 업무, 쇼핑, 블록체인, 암호화폐, 인공지능, 개발, 인물, 행사, 일반
|
|

 해시넷
해시넷