제련
제련(smelting, 製鍊)은 고온에서 광석으로부터 금속을 추출하는 공업적 조작을 말한다. 제련은 열이나 화학적, 전기적 방법을 이용하여 광석으로부터 금속을 필요한 순도로 추출하여 지금(地金)의 형태로 만드는 공정을 말한다. 광석 제련의 공정은 조(粗)제련과 정(精)제련으로 나눈다.[1][2][3]
목차
개요[편집]
제련은 넓은 의미로는 광석이나 유용 금속을 함유하는 원료에서 금속을 분리하여 얻어지는 조금속을 정제하여 순금속 또는 합금과 금속 화합물을 최종 제품으로 하는 공업 공정이다. 철광석을 코크스와 석회석과 섞어서 용광로에 넣고 아래쪽에서 열풍을 보내면 코크스는 산소와 반응하여 일산화 탄소(CO)가 되고 이 일산화 탄소가 산화 철을 환원시켜 철이 생성된다. 목적하는 금속의 함유량, 화학적 형태가 적당하고 그 금속을 경제적으로 추출할 수 있는 광물을 그 금속의 광석이라고 한다. 광석 제련의 공정은 조(粗)제련과 정(精)제련으로 나누는데, 조제련을 좁은 뜻의 제련, 정제련을 정련이라고 하는 경우도 있다. 광석 속에 있는 목적 금속의 농도는 높아졌지만 여전히 불순물을 충분히 제거하지 못한 단계까지를 조제련이라고 하는데 이 단계에서 금속은 단일체가 아니고 화합물의 형태를 띤다. 다음으로 이 조제련 제품을 더욱 정련하여 목적 금속의 순도까지 높여 지금으로 사용할 수 있는 단계로 높이는 작업을 정제련이라 한다. 또한 제철, 제동과 같이 용광로를 사용하여 제련하는 경우는 영어의 'smelting'에 해당하며 용련(熔鍊)이라고도 한다. 주로 미국에서는 광석으로부터 목적 금속을 추출하는 공정을 추출야금(extractive metallurgy)이라고 한다. 광석은 광산에서 채굴한 후 적당한 방법으로 선광하여 불필요한 성분을 가능한 한 제거하고 목적 금속의 함유율을 높여서 제련 공정으로 보낸다.[4]
종류[편집]
광석의 제련법은 크게 건식 제련과 습식 제련 두 가지로 나뉜다. 이 밖에도 아말감법이라는 방법이 있다.
건식 제련[편집]
광석과 환원제(다른 물질을 본래 상태로 돌아가게 하고 자신은 산화되는 물질) 및 용제(물질을 녹이는 데 쓰는 액체)를 섞어서 용광로에 넣고 가열하면 환원 반응이 일어나서 금속이 되고 높은 온도로 인해 금속은 녹아서 용융(녹아서 섞임) 상태가 된다. 그리고 맥석이나 불순물은 용제와 결합하여 슬래그(제련한 뒤 남은 찌꺼기)를 만든다. 용융 상태의 금속과 슬래그는 용광로에 고이게 되는데 금속은 아래쪽에 가라앉고 슬래그는 위쪽에 뜬다. 이렇게 하여 금속을 구분해 낼 수 있다. 철의 제련에서는 환원제로 코크스가 쓰이고 용제로 석회석이 쓰인다.
습식 제련[편집]
광석을 가루로 만들어 황산, 염산, 수산화나트륨 등의 화학 약품에 녹인 다음 그 수용액을 진하게 농축하여 정제한다. 이것을 다시 전기 분해하여 금속을 골라내거나 수용액에서 금속 산화물을 얻어 환원제로 환원하여 금속을 얻는 방식이다. 구리의 광석을 선광한 다음,이것을 빻아 묽은 황산에 녹이면 황산구리 용액이 되는데 이것을 전기 분해하여 순수한 구리를 얻는 것이 그 예이다.
아말감법[편집]
금광석 등을 잘게 빻아 수은을 가하면 수은과의 합금인 아말감이 얻어지고 이것을 가열하여 수은을 제거하면 금을 얻을 수 있다. 이러한 방식을 아말감법이라고 한다. 수은의 분량이 많으면 합금이 액체로 되나 대부분은 고체이다. 수은은 금, 은, 구리, 아연, 카드뮴, 납 등과 합금하면 아말감이 된다. 상온에서 액체 또는 매우 무른 고체의 합금을 만드는데 이것은 약간만 가열하면 무르게 되므로 세공하기가 쉽다. 주석, 카드뮴의 아말감은 치과용 충전재로 쓰이고, 또 납, 주석, 비스무트의 아말감은 거울의 뒷면에 칠하여 반사를 돕기 위해 이용되고 있다. 수은을 이용해 도금할 때도 곧잘 썼는데 아무래도 이 아말감법은 수은을 증발시킬 때 그 증기로 인해 매우 위험하다.
용광로[편집]
용광로(鎔鑛爐, Blast Furnace)는 금속가공에서 금속 및 합금을 생산하기 위한 제련을 하는 데 사용되는 설비이다. 문자 그대로 광을 녹이는 로라는 뜻으로 생산하는 금속의 종류를 막론하고 환원 용융을 쓰면 그게 바로 용광로다. 이런 용광로중 현대식 용광로는 특별히 고로(高爐, Shaft Furnace)라고 불리는데 보통 높이가 10~25미터에 이르는 높은 원통형이므로 이런 이름이 붙었다. 한국에서는 고로까지 퉁처서 용광로라는 표현을 주로 쓰는 데 비해 일본에서는 고로라는 용어를 따로 구분해 쓴다.
용광로의 구조는 매우 간단하다. 벽돌로 쌓아올린 굴뚝 모양으로 되어 있으며 안에는 별다른 장치가 없다. 노의 꼭대기로부터 철광석과 코크스와 석회석을 넣은 다음 밑에서 얼마 안 되는 옆부분에 있는 20여 개의 구멍으로 약 800°C의 열기를 불어 넣는다. 이 열기를 받으면 노 속의 코크스가 불완전 연소하여 2,000°C에 가까운 일산화탄소로 된다. 일산화탄소는 용광로 내부를 상승하면서 철광석을 가열하고 동시에 산소를 빼앗는 환원반응을 하여 이산화탄소로 바뀐다. 일산화탄소는 위로 올라갈수록 온도가 떨어지고 그 농도도 낮아져서 광석을 가열, 환원하는 힘이 줄어든 후 외부로 배출된다. 이와 같이 용광로 속에서의 첫 과정은 탄소가 일산화탄소로 바뀌는 일이다. 이때에 열이 발생하므로 환원반응은 훨씬 촉진되며 일산화탄소는 환원제로서 산화철 속의 산소를 빼앗는다. 이 반응은 낮은 온도에서는 진행되지 않지만, 2,000°C 가까운 일산화탄소에 의해서 고온에서는 잘 진행된다.[5][6]
철 제련 역사[편집]
철은 알루미늄에 이어 지각에 두 번째로 많이 존재하는 금속이다. 철의 전 세계적 매장량은 약 8천억 톤이며, 연간 철강 생산량은 12억 톤 정도이다. 인류는 기원전 3천 년경부터 철을 이용해 왔다. 철은 구리보다 반응성이 높아서 자연계에 적철석(Fe203), 자철석(Fe304) 등 산화물 상태로 존재하며 녹는점(1538℃)이 높아 순물질로 분리되기 어려웠다. 그래서 구리보다 훨씬 풍부하게 매장되어 있음에도 불구하고 산화철에서 철을 얻는 제련법이 개발된 이후에야 본격적으로 쓰이기 시작한 것이다.
초기 철의 제련법[편집]
고대인들은 구리(녹는점 1083 ℃ )나 주석(232 ℃ ) 광석을 숯과 함께 가열하면 금속 구리와 주석이 얻어진다는 것을 알았다. 철광석에서 철을 야금하는 데는 훨씬 높은 온도가 필요하다. 초기 철 야금은 철광석을 목탄불 속에 넣어서 철로 환원시키는 것이었다. 강력한 송풍 장치를 사용했음에도 노의 온도가 1000℃를 못 넘어서 철 덩어리가 반액체상 슬래그 속의 다공성 스폰지 철, 즉 해면철(sponge iron)이 얻어진다. 이 해면철에 열을 가하고 두드리며 불순물을 제거하면 탄소 함량이 0~0.2%인 연철(soft iron)이 되며 연철을 다시 숯불 위에서 가열하여 탄소를 흡수시키고 담금질하면 탄소 함량이 0.04~1.7%이고 단단한 강철(steel)이 된다. 기원전 1500년경 히타이트족이 터득한 이러한 기술은 기원전 1180년 히타이트 왕국이 멸망하며 다른 지역으로 전파되었고 용광로가 발명되기 전까지는 거의 그대로 사용되었다. 강철로 철제 무기와 농기구를 만들게 되면서 그리스에서는 기원전 1100년경, 메소포타미아에서는 기원전 900년경, 중앙 유럽에서는 기원전 500년경, 인도와 중국에서는 기원전 1200~500년경에 철기 시대가 도래하였다. 철은 구리보다 구하기 쉽고 튼튼해서 좋은 농기구를 많이 만들 수 있었고 따라서 철 덕분에 고대 사회의 농업 생산력이 크게 높아졌다.
현대 철의 제련법: 고로법[편집]
오늘날에는 철의 제련에 용광로를 사용한다. 노 아래서 공기를 불어넣으며 노 꼭대기에 철광석, 석회석(CaCO3), 고체 탄소 연료인 코크스(주성분 C)를 넣으면, 이들이 내려가면서 철광석이 환원되고 용융된 철이 제일 밑 출구로 분리되어 나온다. 이렇게 얻은 철은 철은 탄소 함량이 1.7%이상(3.5~4.5%)으로 선철(무쇠, pig iron)이다. 맨홀 뚜껑을 만드는 데 쓰며 단단하지만 녹는점이 낮고 잘 부서진다. 선철에서 탄소 적정량과 황(S), 인(P) 등 불순물을 제거하면 철근, 자동차 차체 등에 다양하게 쓰이는 강철을 얻을 수 있다.
적철석이 환원되는 과정을 화학 반응식으로 나타내면 다음과 같다.
- 2C(s) + O2(g) → 2CO(g)
- Fe2O3(s) + 3CO(g) → 2Fe(s)환원 + 3CO2(g)산화
- Fe3O4(s) + 4CO(g) → 3Fe(s)환원 + 4CO2(g)산화
코크스 탄소가 불완전 연소하여 일산화탄소가 생기고 일산화탄소가 철광석을 환원시켜서 순수한 철인 선철로 만든다. 한편 석회석(CaCO3)은 산화칼슘(CaO)와 이산화탄소(CO2)로 분해되어 불순물을 제거해 준다. 산화칼슘은 철광석 속의 불순물인 이산화규소(SiO2)를 규산칼슘(CaSiO3), 통칭 슬래그로 바꾼다. 액체 상인 선철은 밀도가 커서 아래로 분리되어 나오고 찌꺼기 슬래그는 밀도가 작아 위로 분리되며 시멘트나 벽돌을 만드는 데 쓰인다.
이러한 고로법은 중국에서는 5세기에, 유럽에서는 중세 중반에 사용되기 시작되었으며, 15세기경 벨기에와 영국으로 전파되었다. 처음에는 연료로 목탄을 썼으나 효율도 낮고 무엇보다 목탄이 부족했기 때문에 석탄을 쓰기 시작했다. 하지만 석탄에는 철강의 질을 낮추는 황(S)이 많이 들어있기 때문에 18세기에는 석탄 대신 코크스를 만들어 사용하였다. 19세기 초에는 용광로를 예열하는 방법이 개발되었고, 1855년 영국의 베세머(Henry Bessemer; 1813~1898)가 고압 공기를 불어넣어 탄소와 불순물을 없애는 베세머 전로를 발명했다. 이는 우수한 철강을 훨씬 빠르고 쉽게 생산할 수 있게 해 주어 산업혁명에 박차를 가했다. 또 19세기 후반부터는 철에 크로뮴(Cr), 니켈(Ni) 등을 섞어 스테인리스강(stainless steel)을 비롯한 합금강으로 철의 큰 단점이었던 녹슮도 극복하게 된다.[7]
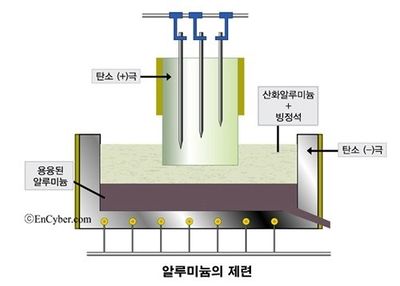
알루미늄 제련[편집]
알루미늄(Al)은 지구의 지각에서 가장 풍부한 금속 원소다. 지각 무게의 약 8.2%를 차지하는데 이는 철(약 5.6%)보다 많은 양이다. 흔한 물질을 싸게 마련이지만 알루미늄은 한때 웬만한 귀금속보다 비쌌다. 금속으로 제련하기 쉽지 않기 때문이다. 알루미늄은 상대적으로 반응성이 큰 금속이라 자연 상태에서는 주로 화합물로 존재한다. 19세기 중반만 하더라도 이를 순수한 금속으로 만들기 어려워 알루미늄은 귀금속으로 취급받았다. 프랑스의 나폴레옹 3세는 신분이 높은 손님은 알루미늄 식기로 신분이 낮은 사람은 금이나 은으로 만든 질이 떨어지는 식기로 대접했다고 전해진다. 결국 알루미늄의 활용 가능성은 얼마나 저렴한 제련법을 찾느냐에 달려 있었다. 미국의 화학자 찰스 마틴 홀은 대학생 시절 알루미늄 제련법을 발견하면 엄청난 부자가 될 것이라는 교수의 말을 듣고 연구를 시작한다. 1886년 그는 빙정석을 이용해 알루미늄을 녹인 후 전압을 걸어 순수한 알루미늄을 추출하는 '전기분해법'을 개발하는 데 성공했다. 그런데 이 방법을 발견한 사람은 찰스 마틴 홀 뿐만이 아니었다. 거의 비슷한 시기 프랑스의 화학자 폴 루이 투생 에루도 독자적으로 알루미늄 전기분해법을 발견했다. 누가 먼저 전기분해법을 발견했느냐를 두고 다툼이 있었지만 홀은 미국에서, 에루는 유럽에서 특허를 인정받기로 했다. 그 결과 홀은 1889년 4월 2일, 미국에서 전기분해법의 특허를 취득했다. 지금은 이 방법을 '홀-에루 공정'이라고 부른다. 홀-에루 공정의 영향으로 알루미늄의 가격은 폭락하기 시작했다. 19세기 중반 kg당 1000달러가 넘던 알루미늄 가격은 50년이 지나자 1달러 이하로 떨어졌다. 은박 포일부터 자동차 엔진까지 알루미늄이 우리 생활 모든 곳에 널리 쓰이는 것은 홀-에루 공정 덕분이다.[8]
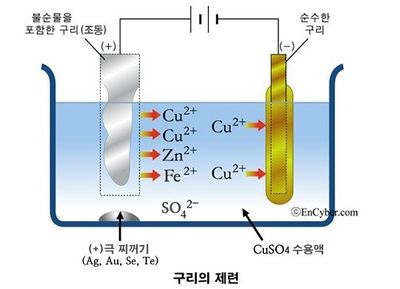
구리 제련[편집]
기원전 5,000년 고대 이집트에서는 이미 구리를 사용하고 있었으므로 구리와 그 합금의 역사는 매우 오래되었다. 처음에는 자연동을 주워 모아서 사용했을 것으로 생각되며 공작석(CuCO3·Cu(OH)2)이나 남동석(2CuCO3·Cu(OH)2)과 같은 환원성이 강한 광석이 모닥불 바닥에서 구리가 되기도 하였을 것이다. 구리는 황과 친화하는 성질이 강하다. 따라서 천연적으로는 대부분 황동석(CuFeS2)이나 휘동석(Cu2S)과 같은 황화물의 형태로 생산된다. 철광석의 경우는 광석 속에 철분 50~60% 함유되어 있으므로 바로 용광로에 넣을 수가 있으나 동광석의 경우는 암석 성분의 맥석이 많고 구리의 함유량은 보통 1 ~ 2% 정도이다. 그러므로 광석을 빻아 불필요한 맥석과 필요한 광물을 분리하는 공정을 거쳐야 한다. 이 조작을 선광이라고 하며 선광에 의해서 가려진 유용 광물을 정광이라고 부른다. 선광에는 광석의 분쇄와 유용 광물의 함유율을 높이기 위한 조작이 포함된다.
구리와 같은 황화 광물에 많이 쓰이는 방법은 부유선광법이다. 우선 광석을 0.2mm 이하로 빻아 흙탕물 모양으로 만든 다음 활성제를 넣어서 유용 광물의 표면에 내수성이 생기게 한다. 여기에 발포제를 넣어 섞으면 흙탕물 속의 광물은 발포제 때문에 생긴 거품에 흡착되어 떠오른다. 이 입자를 농축하면 정광이 된다. 이렇게 하면 함유율이 5%이던 광석이 유용 광물 50% 이상을 함유하게 되므로 정련하기 쉽다. 구리의 정광은 황화동, 황화철과 선광 과정에서 미처 분리되지 않고 남은 맥석으로 되어 있다. 이것을 소형 용광로에 넣고 산화 용융하면 산소와의 결합력이 강한 FeS가 먼저 산화해 FeO가 되고 이것은 맥석의 SiO2 등과 함께 슬래그를 이룬다. 구리는 Cu2S로 그대로 남아서 FeS의 일부와 함께 녹아 슬래그 밑에 괸다. 이것을 전로에 넣고 공기를 분사하면 FeS가 먼저 산화하여 슬래그로 되고 황화 구리의 산화가 진행함에 따라, Cu2S+2Cu2O → 6Cu+SO2로 되어 구리가 생긴다. 이 때의 구리는 순도가 낮은 조동(租銅)이며 그 순도를 높이기 위해서 다시 전기분해법에 의한 정련을 하여야 한다.[9]
각주[편집]
참고자료[편집]
- 〈제련〉, 《위키백과》
- 〈구리〉, 《위키백과》
- 〈용광로〉, 《위키백과》
- 〈용광로〉, 《나무위키》
- 〈제련〉, 《네이버 지식백과》
- 〈제련(製鍊)〉, 《네이버 지식백과》
- 〈제련 (smelting, 製鍊)〉, 《네이버 지식백과》
- 이내, 〈철의 제련(제련 방법의 역사)〉, 《네이버 블로그》, 2014-06-06
- 이창욱 기자〈(잠깐과학)금보다 비쌌다고? 알루미늄 제련법 개발!〉, 《동아사이언스》, 2020-04-04
같이 보기[편집]

 해시넷
해시넷