메탄올
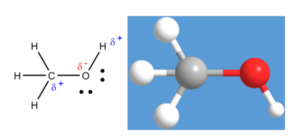
메탄올(methanol, methyl alcohol, 甲醇)은 화학식 CH₃OH, 메틸 알코올'이라고 부르며 나무로부터 많이 얻어진다고 하여 목정(wood spirit) 이라고도 한다. 1661년에 보일(Robert Boyle)에 의해 회양목의 증류 과정에서 최초로 분리되었다. MeOH로 쓰기도 하며, 알코올 중에서 가장 간단한 구조로 되어 있다. 물보다 가볍고, 무색의 가연성이 있는 극성을 띠는 액체이며, 맛과 냄새는 술의 주성분인 에탄올과 비슷하다. 메탄올은 극성 분자이고, 수소 결합을 한다.
메탄올은 혐기성 생물의 대사 과정에서 자연적으로 만들어지기도 한다. 조금 마시면 눈이 멀고, 많이 마시면 사망에 이르는 경우도 있다. 부동액, 연료 등으로 쓰이며 다양한 화학 반응에서 용매 또는 주요한 출발 물질로 사용된다.
목차
구조 및 특성
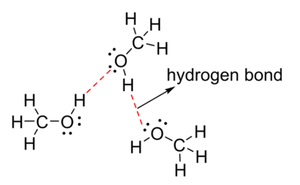
메탄올은 구조적으로 메틸기와 하이드록실기가 공유 결합한 형태를 가지고 있다. 하이드록실기의 산소는 결합한 탄소와 수소보다 전기음성도가 강하여 전자를 산소 쪽으로 당기는 성질을 나타낸다. 이에 따라 메탄올의 탄소와 수소는 부분 양성 전하(partial positive charge)를 띠며, 산소는 부분 음성 전하를 띠게 된다. 이러한 이유로 메탄올은 극성을 가지며, 극성을 나타내는 척도인 쌍극자 모멘트 값이 1.70이고 물(1.8546)보다는 극성이 약하나 에탄올(1.69)보다는 약간 강한 극성을 나타낸다. 메탄올의 산소는 주위에 있는 메탄올 하이드록실기의 수소와 수소 결합을 한다.
제법
높은 온도와 압력에서 일산화 탄소 또는 이산화 탄소와 수소 기체를 출발 물질로 사용하고 구리와 산화 아연 같은 촉매를 이용한 반응으로부터 얻을 수 있다.
CO(g) + 2H₂(g) --> CH₃OH(g)
생물자원(biomass)이나 나무, 천연가스, 도시의 쓰레기 더미 등으로부터 얻는 방법도 있다. 메테인을 이용한 메탄올 제조 방법도 많이 연구되고 있으며, 메테인 일산소화효소(methane monooxygenase)에 의해 메테인이 산화되면 메탄올을 얻을 수 있는데, 생성된 메탄올이 계속 산화된다는 문제점이 있다.
혈구염색과 메탄올
혈구들을 살아 있는 상태로 유지하기 위해서 혈구 관찰 시 슬라이드 글라스에 메틸알코올을 가하는데, 이것을 고정이라고 하며, 특히 백혈구의 고정에 용이하다.
메탄올과 에탄올의 차이 및 구별법
메탄올과 에탄올은 성상이나 냄새는 매우 유사한 성질을 가지고 있지만, 많은 차이점도 있다. 에탄올은 메탄올보다 탄소가 하나 더 많은 알코올이며, 메탄올은 연소 시 밝은 흰색을 나타내지만 에탄올은 밝은 파란색을 띤다. 에탄올은 주류의 원료로 사용되나 메탄올은 소량이라도 섭취할 경우 실명을 초래할 수 있는 매우 위험한 알코올이다. 수산화 소듐과 아이오딘을 사용하는 아이오도폼 반응을 이용하면 에탄올은 반응하여 노란색 고체인 아이오도폼을 생성하지만, 메탄올은 반응하지 않는다. 이러한 차이를 이용하여 유사한 두 알코올을 쉽게 구별할 수 있다.
생산량 및 경제 가치
전 세계적으로 약 90여 개의 메탄올 생산 공장에서 연간 1380억 리터를 생산한다. 2015년에 전 세계 수요는 약 870억 리터인 것으로 보고되었으며, 수요의 약 40%는 신생 에너지 분야에 있다. 매일 약 2억 8400만 리터가 화학 원료나 운송 연료로 사용되고 있다. 2016년 2월부터 2017년 2월까지 1년 사이에 메탄올 가격은 180%가 올라 1톤당 USD 500에 거래되었다. 가격 상승의 주된 요인은 천연가스 등 원료의 가격 상승과 공급의 제한, 메탄올의 올레핀화를 위한 시설 등 중국과 미국의 수요 상승을 들 수 있다. 메탄올 산업의 경제적 가치를 살펴보면 연간 약 550억 달러의 경제 활동을 창출하고 9만여 개 이상의 일자리를 창출한다.
용도
화학 반응에서 중요한 용매 또는 반응 출발 물질로 흔히 사용된다. 공업용으로 중요한 폼알데하이드, [[아세트산, 프로필렌, 프로페인 가스 대체용 다이메틸 에터(DME) 등의 생산에 사용된다. 환경 오염을 고려한 자동차 연료의 첨가제로 사용되는 메틸 삼차 뷰틸 에터(MTBE) 제조 시에도 사용된다. 전력 수요가 많은 여름에 백업 발전기의 연료로도 사용된다.
해양연료
최근 국제 해사 기구(International Maritime Organization)는 대형 선박에 대한 항해 중 연료 배기물(산화 황, 산화 질소 등)에 의한 오염 규제를 강화했고, 이러한 규제에 따르기 위하여 메탄올 연료 사용이 급증하고 있다.
자동차 연료
중국이나 인도에서는 환경, 경제, 에너지 자급자족 등을 고려하여 연료로써 메탄올과 휘발유를 혼합해서 사용하는 것을 장려하고 있다. 특히 중국에서는 메탄올이 총 운송 연료 사용량의 7%를 차지하고 있으며, 차들이 순수 메탄올(M100)이나 메탄올 85%와 휘발유 15%(M85) 등의 높은 비율의 메탄올 사용이 가능하도록 개조되었다. 사고 시 안전을 고려하여 경주용 자동차 연료로 사용되기도 한다.
연료 전지
메탄올은 다른 액체보다 상온에서 이상적인 수소 운반체 역할을 하고 있으며, 이러한 특성을 이용한 것 중의 하나가 직접 메탄올 연료 전지(Direct Methanol Fuel Cell; DFMC)이며 물과 메탄올의 전기 화학 반응으로부터 발생하는 수소를 이용해서 전기를 만든다. 2017년 초에는 메탄올 배터리를 이용한 유람선(MS Innogy)이 독일에서 처음으로 운항하였다.
바이오디젤
바이오디젤 연료 생산 시 에스터 교환 반응에서 메탄올은 트라이글리세라이드와 반응하여 지방산 알킬 에스터(바이오디젤 연료)로 전환하는데 사용된다.
폐수 처리
메탄올은 폐수 처리 시설에서 배출되는 폐수를 감소시키는 데 중요한 역할을 한다. 탈질화 반응(denitrification) 과정을 통해 폐수 처리 시설은 과량의 질산염을 질소로 변환하여 대기로 방출하게 된다. 이에 따라 조류가 자라는 것을 방지하고 산소와 햇빛이 표면 아래의 해양 생물에 도달할 수 있도록 도와준다. 메탄올은 탈질화 반응에 가장 많이 사용되는 유기 화합물로써 해로운 질산염을 분해하는 혐기성 박테리아의 활동을 촉진한다.
독성
메탄올을 10 mL 정도 섭취할 경우 알코올 탈수소효소에 의해 폼알데하이드로 대사된 후 알데하이드 탈수소효소에 의해 폼산으로 대사되고 궁극적으로 시신경을 손상해 영구 실명, 혼수상태, 죽음에 이를 수 있다. 이런 메탄올의 독성을 이용하는 한 예로 공업용 에탄올 제조 시 에탄올이 술을 만드는 데 오용되지 않게 하려고 메탄올을 첨가제로 사용한다.
참고자료
같이 보기

 해시넷
해시넷